Hum Mol Genet:我们定义了核小体保卫区域NSR,揭示了细胞身份维持新机制
日期:2017-11-01
2017年11月1日,罗怀兵同学题为Cell identity bookmarking through heterogeneous chromatin landscape maintenance during the cell cycle的文章在Hum Mol Genet(IF=5.34)杂志Online。下面是相关的解读文章。
世界上很多理所当然的事情,都有其内在的根源。
大千世界,“变”是永恒的的主题(唯一不变的就是变),构成生命体的细胞也是一样,在有丝分裂过程中,必须维持“变”与“不变”的平衡。当这种平衡被打乱,细胞身份将难以维持,要么发生万分之一概率的细胞重编程,要么细胞身份紊乱进而步入病变甚至癌变的不归路。一个肝细胞在有丝分裂后变成两个肝细胞,并不是想象的那么简单,正是“变”与“不变”博弈的结果。
变化是生命的本质属性,不变是生命存在的前提
生命如此多元,小到细菌、蚂蚁,大到人类、鲸鱼,它们共同构成了这个多姿多彩的世界。生命的本质属性是什么?有人说,生命的本质属性是变化。对于我们人类这种多细胞生物而言,在时间的维度上,我们从受精卵到个体(从 0 到 1),随后经历少年、青年、中年、老年,最终归于尘土(从 1 到 0);在空间的维度上,人体内包含 200 多种细胞,细胞与细胞之间又是如此不同,它们在各自的轨道上重复着从 0 到 1 再到 0 的循环。
图 1. 人体包含多种类型的细胞
从细胞层面思考,在细胞分裂过程中,细胞遗传物质先进行拷贝,平均分配到两个子细胞中去,最后实现细胞的复制。但为什么肝细胞分裂后,依然是两个肝细胞;肺细胞分裂后,依然是两个肺细胞?像这种我们平时认为不是问题的问题,有个专有名词叫做 Bookmarking,即细胞在有丝分裂过程中存在维持细胞自身身份的“书签”,而这种现象毫无疑问是通过表观遗传学进行精密调控的。在细胞有丝分裂过程中存在两个重要的核心问题:(1) 细胞如何在细胞周期中保持细胞自己特定的身份(Cell identity),(2) 细胞通过什么机制保证不会变成其他细胞。正是这种“变”与“不变”的平衡共同维持了细胞身份在有丝分裂中的稳定遗传。
“皮之不存,毛将焉附”
细胞身份该如何定义?对于人体内的 200 多种细胞,每一种细胞都有其特定的基因表达模式。广义上的细胞身份可以理解为细胞中基因的时空表达模式。而对于细胞身份的维持而言,任何一个活细胞一定会处在细胞周期中的某一个时期,即 G1 期、S 期、G2/M 期或 G0 期,但是处在任一时期的细胞都需要维持其特定的细胞身份。举例来说,肝细胞在细胞周期的任一时期都应该是肝细胞,既要表达肝细胞特有的基因,而且保证不能表达其他器官组织相关的基因。在 G1 期、G2/M 或 G0 期比较好理解,带有组蛋白修饰的核小体缠绕在DNA 上调控基因的表达,维持细胞的身份。
但在 S 期,事情就变得相当复杂,因为这涉及到另外一个常识性的问题。在有丝分裂的 S 期,随着DNA的复制,DNA双链与组蛋白八聚体紧密缠绕形成的核小体必须滑开或者移除,以保证 DNA 处于开放状态,进行复制或者必要的转录。如果表观遗传学因素(包括组蛋白修饰)在细胞有丝分裂过程中是维持细胞身份的决定因素,而此时的问题是,在全基因组水平上核小体缺失(“皮之不存”)的情况下,在 S 期处于开放状态的 DNA 通过表观遗传学机制(此时组蛋白修饰将无所依附)维持细胞身份就显得力不从心,而确保细胞不会变成其他细胞就成了“空口承诺”。
NDR 只回答了问题的一半
早在 2004 年,Bradley E Bernstein 等在研究酵母核小体占位时,就提出了“启动子区域核小体缺失”(nucleosome-depleted promoters)的概念。他们发现,“核小体缺失的启动子”可提供转录因子的结合位点,进而调控基因表达。2011 年,研究人员进一步发现,启动子附近的“核小体缺失区域”(Nucleosome-depleted regions, NDRs)通过改变共激活因子结合位点的覆盖率,进而调控特定基因的表达,这提示 NDRs 可能在细胞周期中通过开放细胞特有基因区域的染色质状态,进而使细胞自身特有基因得以表达保证细胞身份的传递。
NDRs 的相关研究仅仅解释了细胞为什么可以维持身份,即“如何忠实做自己”,但不能回答细胞在有丝分裂后“为何不会背叛自己”。从逻辑上,目前只证明了必要性,还缺少充分性的证明。比如一个学生在考试的时候自然会出现在考场,但是你不能断言出现在考场中的人就一定是正常的学生;如果这个学生在试卷上写的是自己的名字(有一些不会,比如枪手会做一些不该自己做的事情),那么基本就可以断定他是正常的学生了。类似地,在细胞分裂过程中,细胞只表达自己特异性的基因对于维持身份是不够的,它还必须去抹除掉其他的可能性,比如肝细胞中的肺特异性的基因必须被抑制掉,反之亦然。那么问题来了,NDRs 只负责表达该细胞类型特异性的基因,谁来负责关闭或抑制其他细胞类型特异性的基因呢?(只信奉文章影响因子的看官可以不用往下看了)
NSR 闪亮登场,留下问题一串串
复旦大学于文强课题组最近在 Human Molecular Genetics 发表题为 Cell identity bookmarking through heterogeneous chromatin landscape maintenance during the cell cycle 的文章,发现在细胞周期中(与 NDRs 相对应)还存在一种“核小体安保区域”(Nucleosome-Secured Regions,NSRs),提出了 NSRs 在细胞周期中与 NDRs 共同维持了细胞身份的遗传,确保细胞在有丝分裂后不会背叛自己的身份。

图 2. NSRs 相关文章
1. 核小体在 S 期的缺失是显而易见的。通过对细胞周期四个不同时相(G0/G1、S1 (early S)、S2 (late S) 和 G2/M)的肝癌细胞系 HepG2 进行核小体占位和甲基化组测序(Nucleosome Occupancy and Methylome sequencing,NOMe-seq),发现核小体占位在不同细胞时相呈现动态变化,在 DNA 复制的 S 期最低,在 DNA 复制结束后,核小体占位又恢复到原来的水平。选取 CTCF 结合位点附近的序列进行验证,发现在距离 CTCF 结合位点上下游各 2000bp 的窗口中,核小体占位呈现显著的动态变化,这说明核小体在 S 期整体上是缺失的,与我们的猜想一致。
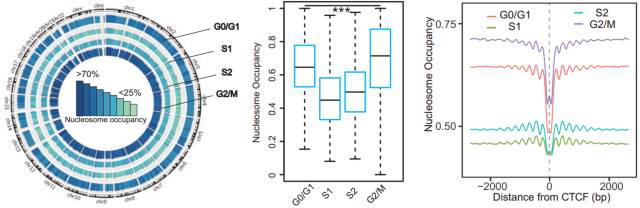
图 3. 核小体占位在四种细胞周期中呈现动态变化
2.DNA甲基化模式在 S 期的不变出乎意料。核小体占位在细胞周期中呈现动态变化,那么什么因素决定了核小体占位的动态变化呢?DNA 紧密缠绕在组蛋白八聚体上构成核小体上,DNA 甲基化模式对核小体占位产生影响吗?通过对细胞周期不同时相的全基因组 DNA 甲基化进行分析,我们发现 DNA 甲基化在细胞周期的各个时相十分稳定,这与预想的结果严重偏离。因为我们一直被教育的是在 S 期,DNMT1 识别半甲基化 DNA 进而将新合成的 DNA 链甲基化,从而在细胞周期中维持细胞的表观遗传学状态。所以我们认为在 S 期 DNA 甲基化应该比其他时相的细胞低一点,但结果不支持我们的猜想,至少说明在 S 期,DNMT1 酶对 DNA 进行甲基化的速度非常之快。另一方面,正是细胞周期 DNA 甲基化模式的不变构成维持细胞身份的重要表观遗传学基础,这进一步提示细胞特定的 DNA 甲基化模式在细胞有丝分裂后可能是染色质高级结构的全面精准恢复的重要因素。
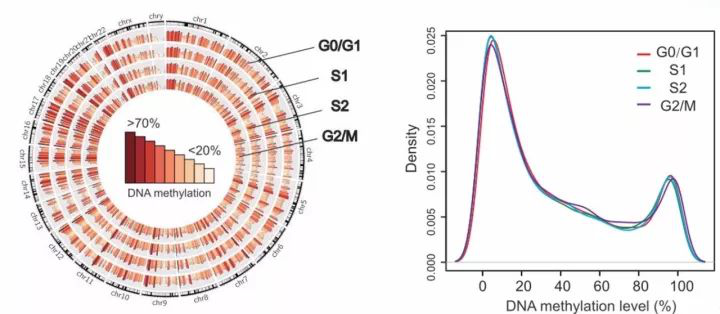
图 4. DNA 甲基化在四种细胞周期中维持稳定
3.NSR发现的偶然性。顾名思义,NSRs 与 NDRs 相对,具有很高的核小体占位率。在基因组的某些区域,核小体变得稀疏,而周围区域核小体较为聚集。在获得 S 期的核小体占位数据后,鉴于大部分核小体缺失,我们想问的问题是,这些核小体的缺失在基因组上是均衡的缺失还是有选择的缺失呢?如果是不均衡的缺失,那么是否存在一些相对的核小体聚集区域呢。通过分析,我们的答案是“Yes”,在S期核小体的缺失是不均衡的缺失,即在基因组的某些区域核小体依旧有很高的占位率,我们把这些中间高两边低的核小体占位区域命名为NSR(Nucleosome-Secured Regions)即“核小体安保区域”。
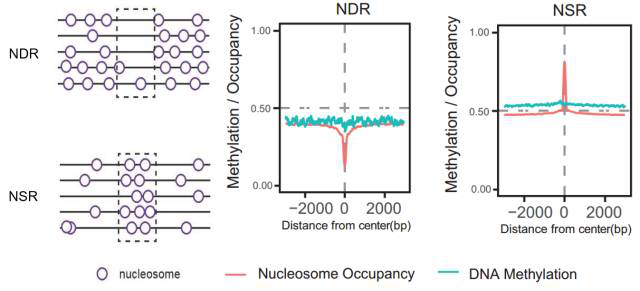
图 5. NSR 与 NDR
4. NSRs 在细胞周期中稳定维持且参与基因的沉默。让我们再次把目光聚焦到核小体占位变化产生的 NSRs 上,分析发现 NSRs 在 G0/G1、S2、G2/M 期都存在,而且与 DNA 甲基化没有相关性,提示 NSRs 与 DNA 甲基化以不同的机制维持细胞身份。但是,NSRs 究竟在细胞身份维持中发挥什么作用呢?
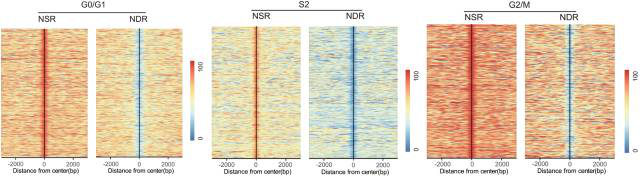
图 6. 不同细胞周期中均存在 NSRs 和 NDRs
我们发现,NSRs 标记的启动子,其调控的基因表达受到抑制;NDRs 标记的启动子,其调控的基因表达较高。特别地,NSRs 标记那些其他细胞特异性的基因,比如在肝癌细胞系 HepG2 中,NSRs 标记与肝脏功能无关的肌肉发育相关的基因,下图展示的睾丸组织特异性的基因 SPO11;而 NDRs 标记对细胞生存所必须的基因,比如细胞代谢相关基因 GCDH。
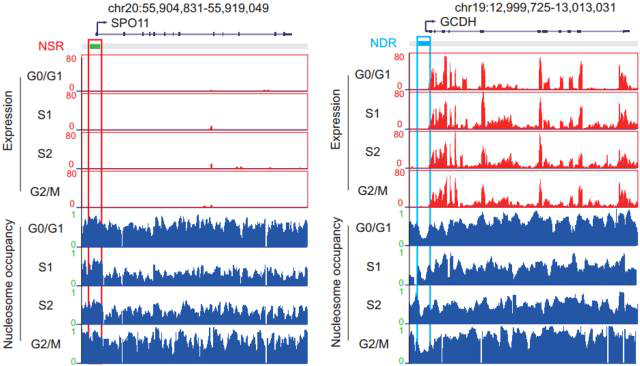
图 7. NSRs 和 NDRs 分别标记其他组织特异性基因和维持细胞生存的基因
此外,NSRs 和 NDRs 在细胞分裂的各个时期都存在,说明 NSRs 和 NDRs 在整个细胞周期中是被预置的(pre-deposited),而并不是从头建立(de novo established)的。
5.NSR的建立和维持。 此前研究表明,H3K27me3 与细胞身份的维持紧密相关。通过分析 NSRs 和 NDRs 的染色质状态,发现 NSRs 标记的区域富集有 H3K27me3、H3K4me3、H3K36me3,缺少 H3K4me1 和 H3K27ac,这揭示了 NSRs 富集在微弱的,处于 poised 状态的启动子、多梳抑制区域以及外显子。
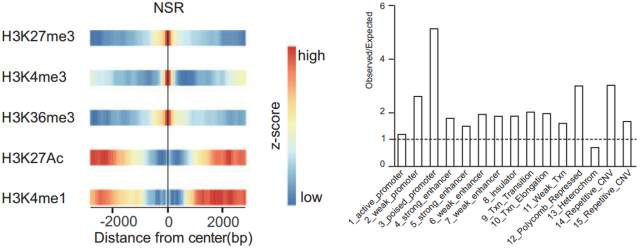
图 8. NSRs 标记的区域的染色质状态
对于 NDRs 区域,虽然这些区域由于缺少核小体结合,因此组蛋白修饰比较少,但还是富集一些活性染色质的标签,比如 H3K4me3、H3K27ac、H3K4me1,这提示 NDRs 选择性地富集在调控元件(比如启动子、超级增强子和绝缘子结合位点)。此外,与 CGI 和非 CGI 启动子附近的区域相比,抑制性的标签 H3K27me3 更多地富集在 NSRs,提示 NSR 可能参与调控组织特异性的基因表达。
6. NSRs 与转录因子的“瑜亮情结”。 NSRs 中核小体占位率很高,尤其是在 S 期,一方面限制了其他组织特异性基因的表达,另一方面核小体的聚集也剥夺了其他组织特异性的转录因子结合的机会,可谓是“一箭双雕”,为细胞身份的维持上了双保险。数据分析也进一步支持了我们的设想,我们发现来源于肝脏肿瘤的 HepG2 细胞系中 NSR 所在区域富集许多神经和肌肉组织特异的转录因子结合位点的 motif,提示 NSR 在维持细胞“非我”基因沉默中的重要作用。 NSR 是细胞周期中保证细胞不会变成其他细胞的重要决定因素,NSR 功能的缺失可能是细胞命运转变的前提条件。转录因子的“我要改变命运”和 NSR 的“你先歇着”构成细胞命运转换与维持中的主旋律。
总而言之,我们的研究提出了一个细胞命运决定中的全新概念 NSRs,并通过对不同细胞周期核小体占位的分析,揭示了 NSRs 在细胞身份维持中具有不可或缺的功能,完善了细胞身份维持的理论体系, 提出NSRs 和 NDRs 的共同作用是细胞身份维持的充分必要条件。
NSR 概念的提出仅仅是一个开始,关于 NSR 还有一系列重要的问题亟待回答:
NSR 所在区域的核小体为什么在 S 期不掉下来?什么因素维持核小体不掉下来?鉴于 S 期 DNA 复制,需要打开双链,这时核小体是如何待在 NSR 区域的(百思不得其解的问题)?
关于 NSR 区域 DNA 序列的特征性分析,除了转录因子的结合特性外,还有哪些特征和功能,许多处于细胞基因组intergenic区域的NSR有什么样的作用?与真核生物的复制起始点有关系吗,与3D基因组等染色质的高级结构有关系吗?
NSR 与细胞命运的决定有关系吗?NSR与细胞重编程的Barrier有什么关系,我们推测在胚胎发育的早期,表观遗传学的剧烈变化导致NSR的缺失,才使胚胎干细胞命运具有万千可能,而随着NSR的恢复,不同组织细胞才开启了各自独立的生命旅程。我们已经知道H3K27me3的抑制剂是最后一个发现并参与诱导细胞重编程过程的化学因子,难道这仅仅是巧合?通过CRISPR技术定点改变NSR,是否可以提高我们重编程或转分化的效率?
NSR 是否在人体细胞中具有保守性,我们最新的结果给出的答案是“Yes”,我们不仅要问NSR在真核细胞生物的进化中也是保守的吗,从低等生物到高等生物的细胞中是否存在NSR,如果存在,NSR将发挥什么作用?
NSR 和肿瘤的关系。肿瘤其实源自于我们自身的细胞,肿瘤细胞就是我们某个器官组织细胞的“叛徒”,但说到底肿瘤就是细胞身份的紊乱。举例来说,一个肝细胞表达自己特有的基因,干好自己份内的事,却偏偏要表达肺组织的基因,可谓“不伦不类”,肿瘤就是这些“不伦不类”细胞的聚集,这样一来,肿瘤的异质性就不难理解了。
可能正是 NSR 的缺失和不当获得使我们正常细胞的身份难以维持,变得“不伦不类”。这里面有许多问题值得研究和思考,我们推测 NSR 区域的基因突变导致 NSR 的缺失也许是肿瘤发生的重要原因,而 NSR 区域的 SNP 也许是某些人容易“倒霉”的因素之一。(对这些问题感兴趣的欢迎联系我们)
我们始终认为,科学研究是要解决问题的,但一项好的研究一定会引出更多的问题,NSR 概念的提出牵出了更多悬而未决的问题。NSR 的发现以及它潜在的功能和意义,欢迎大家讨论,也欢迎大家拍砖。但我们相信 NSR 无疑为我们研究细胞命运的转换提供新的视角,为解释疾病状态下细胞命运的紊乱提供了新思路。
表观遗传学因素和转录因子在细胞命运决定中发挥什么样的作用,一直是生命科学领域争论不休的话题,尽管有证据显示转录因子在细胞命运转换中发挥着重要作用,但是 NSR 的发现告诉我们,如果转录因子的结合位点被 NSR 所占据,即使在细胞命运保护因素最薄弱的S期,转录因子依然很难发挥作用,从而使细胞命运的转换搁浅。从某种意义上说,转录因子要改变细胞的命运,必须征得 NSR 的同意,才有发挥作用的“可乘之机”。可以想象一下,如果没有 NSR 的保护,我们细胞的命运将变得飘泊不定,一有风吹草动,任何一个转录因子都会轻易改变细胞的命运,组织器官的稳态将难以维持,这对一个生命体来讲必然是毁灭性的。
如果细胞“一分两异”,必然导致组织的“一拍两散”,到时候将不是“人无完人”,而是“人完人无”。在细胞命运决定的大是大非面前,NSR 也许会对转录因子说,“哥们,要想改变命运,你还是先”飞“一会吧。
NSR 不可小觑!肿瘤细胞在改变自身命运的同时,也改变了“宿主”的命运,当“宿主”的生命终结之时,肿瘤细胞也必将万劫不复!所以,组成生命体基本单位的细胞,还是踏实一点吧,毕竟“不忘初心,方得始终”。这就是生命的真谛!
------
撰文:复旦大学生物医学研究院徐鹏、于文强
编辑:Epiview
参考文献:
1. Bernstein BE, Liu CL, Humphrey EL, et al. Global nucleosome occupancy in yeast. Genome Biol. 2004;5(9):R62.
2. Bai L, Charvin G, Siggia ED, et al. Nucleosome-depleted regions in cell-cycle-regulated promoters ensure reliable gene expression in every cell cycle. Dev Cell. 2010,18(4):544-55.
3. Luo H, Xi Y, Li W, et al. Cell identity bookmarking through heterogeneous chromatin landscape maintenance during the cell cycle. Hum Mol Genet. 2017,26(21):4231-4243.